Lớp 1-2-3
Lớp 1
Lớp 2
Vở bài tập
Lớp 3
Vở bài tập
Đề thi
Lớp 4
Sách giáo khoa
Sách/Vở bài tập
Đề thi
Lớp 5
Sách giáo khoa
Sách/Vở bài tập
Đề thi
Lớp 6
Sách giáo khoa
Sách/Vở bài tập
Đề thi
Chuyên đề & Trắc nghiệm
Lớp 7
Sách giáo khoa
Sách/Vở bài tập
Đề thi
Chuyên đề & Trắc nghiệm
Lớp 8
Sách giáo khoa
Sách/Vở bài tập
Đề thi
Chuyên đề & Trắc nghiệm
Lớp 9
Sách giáo khoa
Sách/Vở bài tập
Đề thi
Chuyên đề & Trắc nghiệm
Lớp 10
Sách giáo khoa
Sách/Vở bài tập
Đề thi
Chuyên đề & Trắc nghiệm
Lớp 11
Sách giáo khoa
Sách/Vở bài tập
Đề thi
Chuyên đề & Trắc nghiệm
Lớp 12
Sách giáo khoa
Sách/Vở bài tập
Đề thi
Chuyên đề & Trắc nghiệm
IT
Ngữ pháp Tiếng Anh
Lập trình Java
Phát triển web
Lập trình C, C++, Python
Cơ sở dữ liệu

Giải bài tập SGK Hóa học 11 hay nhất
Với giải bài tập Hóa học lớp 11
Đang xem: Hướng Dẫn Giải Bài Tập Hóa Học 11
Chương 1: Sự điện li
Chương 2: Nitơ – Photpho
Chương 3: Cacbon – Silic
Chương 4: Đại cương về hóa học hữu cơ
Chương 5 : Hiđrocacbon no
Chương 6 : Hiđrocacbon không no
Chương 7: Hiđrocacbon thơm. Nguồn hiđrocacbon thiên nhiên. Hệ thống hóa về hiđrocacbon
Chương 8: Dẫn xuất halogen – Ancol – Phenol
Chương 9: Anđehit – Xeton – Axit cacboxylic
Giải bài tập Hóa học 11 Bài 1: Sự điện li
Video Giải bài tập Hóa 11 Bài 1: Sự điện li – Cô Phạm Thu Huyền (Giáo viên thietbihopkhoi.com)
Bài 1 (trang 7 SGK Hóa học 11): Các dung dịch axit như HCl, bazơ như NaOH và muối như NaCl dẫn điện được, còn các dung dịch như ancol etylic, saccarozơ, glixerol không dẫn điện được là do nguyên nhân gì?
Lời giải:
Trong dung dịch: các axit, các bazơ, các muối phân li ra các ion dương và ion âm chuyển động tự do nên dung dịch của chúng có khả năng dẫn điện.
Thí dụ :
HCl → H+ + Cl-
NaOH → Na+ + OH-
NaCl → Na+ + Cl-
Còn các dung dịch như ancol etylic, đường saccarazơ, glixerol không dẫn điện vì trong dung dịch chúng không phân li ra các ion dương và ion âm.
Bài 2 (trang 7 SGK Hóa học 11): Sự điện li, chất điện li là gì? Những loại chất nào là chất điện li? Thế nào là chất điện li mạnh, chất điện li yếu? Lấy thí dụ và viết phương trình điện li của chúng?
Lời giải:
– Sự điện li là sự phân li thành các cation (ion dương) và anion (ion âm) của phân tử chất điện li khi tan trong nước.
– Chất điện li là những chất tan trong nước và tạo thành dung dịch dẫn được điện.
– Các chất là chất điện li như axit, các bazơ, các muối tan được trong nước.
– Chất điện li mạnh là những chất khi tan trong nước các phân tử hoà tan đều phân li ra ion.
– Thí dụ:
H2SO4 → 2H+ + SO42-
KOH → K+ + OH-
Na2SO4 → 2Na+ + SO42-
– Chất điện li yếu là những chất khi tan trong nước chỉ có một phần số phân tử hoà tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
– Thí dụ: H2S ⇌ H+ + HS-
Bài 3 (trang 7 SGK Hóa học 11): Viết phương trình điện li của những chất sau:
a. Các chất điện li mạnh: Ba(NO3)2 0.10 M; HNO3 0,020 M; KOH 0,010 M. Tính nồng độ mol của từng ion trong dung dịch.
b. Các chất điện li yếu HClO; HNO2.
Lời giải:
a. Các chất điện li mạnh
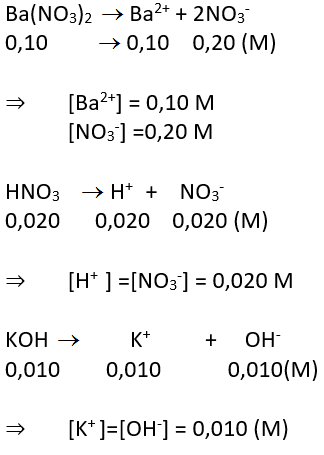
b. Các chất điện li yếu HClO; HNO2
HClO ⇌ H+ + ClO-
HNO2 ⇌ H+ + NO2-
Bài 4 (trang 7 SGK Hóa học 11): Chọn câu trả lới đúng trong các câu sau đây:
Dung dịch chất điện li dẫn được điện là do:
A. Sự dịch chuyển của các electron.
B. Sự dịch chuyển của các cation.
C. Sự dịch chuyển của các phân tử hoà tan.
D. Sự dịch chuyển của cả cation và anion.
Lời giải:
Đáp án D.
Xem thêm: Trường Đại Học Bách Khoa Tiếng Anh, Trung Tâm Ngoại Ngữ Đại Học Bách Khoa Tp
Do khi hoà tan (trong nước) các phân tử chất điện li phân li ra thành các cation và anion.
Bài 5 (trang 7 SGK Hóa học 11): Chất nào sau đây không dẫn điện được?
A. KCl rắn, khan.
B. CaCl2 nóng chảy.
C. NaOH nóng chảy.
D. HBr hoà tan trong nước.
Lời giải:
Đáp án A.
Do KCl rắn, khan tồn tại dưới dạng mạng tinh thể ion, rất bền vững. Không phân li ra được ion dương và ion âm (di chuyển tự do) nên không có khả năng dẫn điện.
Giải bài tập Hóa học 11 Bài 2: Axit, bazơ và muối
Bài 1 (trang 10 SGK Hóa học 11): Phát biểu các định nghĩa axit, axit một nấc và nhiều nấc, bazơ, hiđroxit lưỡng tính, muối trung hoà, muối axit? Lấy các thí dụ minh hoạ và viết phương trình điện li của chúng.
Lời giải:
– Axit: là những chất phân li trong nước ra ion H+
Ví dụ:
HCl → H+ + Cl-
H2S ⇌ 2H+ + S2-
– Axit một nấc: là những axit chỉ phân li một nấc ra ion H+ thí dụ như HCl, HBr…
HCl → H+ + Cl-
– Axit nhiều nấc là những axit phân li nhiều lần ra H+
Ví dụ:
| H2S là axit hai nấc |
H2S ⇔ H+ + HS- HS- ⇌ H+ + S2- |
| H3PO4 là axit ba nấc |
H3PO4 ⇌ H+ + H2PO4- H2PO4-⇌ H+ + HPO42- HPO42- ⇌ H+ + PO43- |
– Bazơ là những chất khi tan trong nước phân li ra ion OH-
Ba(OH)2 → Ba2+ + 2OH-
– Hiđroxit lưỡng tính: là những chất khi tan trong nước vừa có thể phân li như axit vừa có thể phân li như bazơ.
Ví dụ: Zn(OH)2, Al(OH)3, Be(OH)2…
+ phân li kiểu bazơ: Al(OH)3 ⇌ Al3+ + 3OH-
+ phân li kiểu axit: HAlO2 ⇌ AlO2- + H+(Khi đó: Al(OH)3 viết dưới dạng axit HAlO2.H2O)
– Muối trung hoà: là những muối mà phân tử không còn khả năng phân li ra ion H+
Ví dụ: NaCl, K2SO4, NaHPO3, CaCO3, Al(NO3)3…
Al(NO3)3 → Al3+ + 3NO3-
– Muối axit: là muối mà trong phân tử vẫn còn hiđro có khả năng phân li ra ion H+
Ví dụ: NaHSO4, NaHCO3, KH2PO4, K2HPO4…
NaHSO4 → Na+ + HSO4-
Gốc axit HSO4- lại phân li ra H+
HSO4- ⇌ H+ + SO42-
Bài 2 (trang 10 SGK Hóa học 11): Viết phương trình điện li của các chất sau:
a. Các axit yếu H2S; H2CO3
b. Bazơ mạnh: LiOH
c. Các muối: K2CO3, NaClO, NaHS
d. Hiđroxit lưỡng tính: Sn(OH)2
Lời giải:
a. Các axit yếu H2S; H2CO3:
H2S ⇆ H+ + HS-
HS- ⇆ H+ + S2-
H2CO3 ⇆ H+ + HCO3-
HCO3- ⇆ H+ + CO32-
b. Bazơ mạnh LiOH
LiOH → Li+ + OH-
c. Các muối K2CO3, NaClO, NaHS
K2CO3 → 2K+ + CO32-
NaClO → Na+ + ClO-
NaHS → Na+ + HS-
HS- ⇆ H+ + S2-
d. Hiđroxit lưỡng tính Sn(OH)2:
Sn(OH)2 ⇆ Sn2+ + 2OH-
Hoặc H2SnO2 ⇆ 2H+ + SnO22-
4. Đáp án D
Do CH3COOH là chất điện li yếu nên trong nước chỉ phân li một phần
CH3COOH ⇆ H+ + CH3COO-
Vì vậy
D. Một bazơ không nhất thiết phải có nhóm OH trong thành phần phân tử.
Lời giải:
Đáp án : C
A. Sai vì: axit là chất khi tan trong nước phân li ra H+( định nghĩa theo thuyết A-re-ni-ut). Nhiều chất trong phân tử có Hidro nhưng phải axit như: H2O, NH3… B. Sai vì: các hidroxit lưỡng tính trong thành phần phân tử cũng có nhóm OH: Zn(OH)2, Al(OH)3… D. Sai vì: Bazơ là chất khi tan trong nước phân li ra anion OH-, nên trong phân tử bazơ luôn có nhóm OH (định nghĩa theo thuyết A-re-ni-ut)Bài 4 (trang 10 SGK Hóa học 11): Với dung dịch axit yếu CH3COOH 0,10M, nếu bỏ qua sự điện li của nước, thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A.
B.
C.
D.
CH3COOH ⇌ H+ + CH3COO-
Vì vậy
Bài 5 (trang 10 SGK Hóa học 11): Đối với dung dịch axit mạnh HNO3 0,10M nếu bỏ qua sự điện li của nước, thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A.
C.
HNO3 → H+ + NO3-
0,1 0,1 0,1 (M)
⇒
Giải bài tập Hóa 11 Bài 3: Sự điện li của nước. pH. Chất chỉ thị axit-bazơ
Bài 1 (trang 14 SGK Hóa học 11): Tích số ion của nước là gì và bằng bao nhiêu ở 25oC?
Lời giải:
Tích số ion của nước là tích số của nồng độ H+ và nồng độ OH- (
Bài 2 (trang 14 SGK Hóa học 11): Phát biểu định nghĩa môi trường axit, trung tính và kiềm theo nồng độ H+ và pH?
Lời giải:
– Môi trường axit là môi trường trong đó
– Môi trường kiềm là môi trường trong đó
Xem thêm: Đề Tài Nghiên Cứu Khoa Học Răng Hàm Mặt, Nghiên Cứu Khoa Học
Bài 3 (trang 14 SGK Hóa học 11): Chất chỉ thị axit – bazơ là gì? Hãy cho biết màu của quỳ tím và phenolphtalein trong các khoảng pH khác nhau?
Lời giải:
Chất chỉ thị axit –bazơ là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch.